Fundamentos em Síndrome Coronária Aguda: tudo o que você precisa saber sobre complicações pós-infarto agudo do miocárdio – Episódio 4: Ruptura da parede livre
Dr Cesar Augusto Caporrino Pereira

Epidemiologia
A incidência da ruptura de parede livre (RPL) é incerta, em razão da alta taxa de morte súbita extra-hospitalar e do baixo número de autópsias. Na era pré-fibrinolítica, ocorria em cerca de 4% dos casos, reduzindo-se para aproximadamente 0,01% na era da reperfusão. Apesar disso, permanece como a terceira principal causa de mortalidade precoce no IAM com supra, podendo responder por até 30% dos óbitos, atrás apenas do choque cardiogênico e da insuficiência cardíaca congestiva. A trombólise pode antecipar essa complicação ao favorecer hemorragia intramiocárdica, dissecção do miocárdio e ruptura subsequente.
Pacientes com RPL tendem a apresentar as seguintes características:
- Primeiro infarto agudo do miocárdio (IAM)
- Sexo feminino* (no registro SHOCK – não houve essa diferença)
- HAS
- IAM anterior
- Idosos
- Reperfusão tardia
Alguns pacientes apresentam menor risco de evoluir com esse tipo de complicação, seja em decorrência de reperfusão mais precoce, seja por condições que favorecem o desenvolvimento de circulação colateral bem estabelecida, como comorbidades associadas à doença coronariana difusa e multiarterial ou episódios prévios de isquemia, tais como:
- Angioplastia primária
- Reperfusão precoce
- Diabetes mellitus
- IAM prévio
Classificação
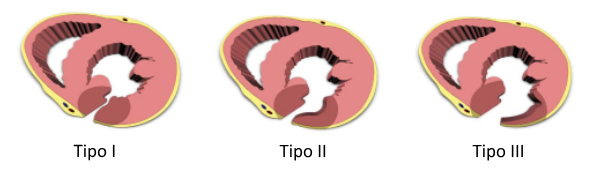
Classificação patológica e anatômica de Becker and van Mantgem:
- Tipo I (laceração abrupta, em forma de fenda, que geralmente ocorre nas primeiras 24 horas do IAM)
- Tipo II (laceração mais lenta com erosão miocárdica localizada do miocárdio infartado)
- Tipo III (perfuração de aneurisma de parede fina, que geralmente ocorre mais de 5 dias após o IAM)
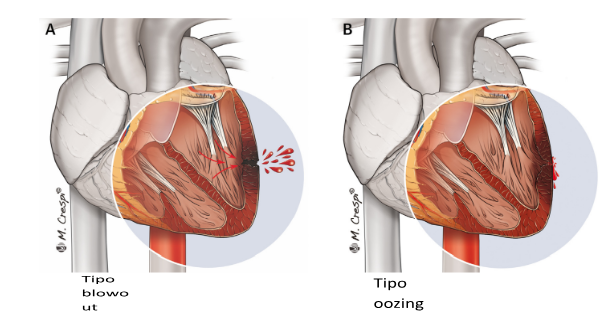
Classificação de Matteucci (mais recente):
- Tipo blowout (ruptura abrupta que leva a instabilidade hemodinâmica e PCR)
- Tipo oozing (exsudação de sangue por meio de hematoma miocárdico intramural confinado, podendo levar derrame pericárdico limitado – severidade variável)
Apresentação clínica
A ruptura de parede livre ocorre, em geral, na primeira semana após o IAM, estando associada a alta mortalidade hospitalar, em torno de 80%. A apresentação clínica inclui dor torácica, choque cardiogênico ou mesmo parada cardiorrespiratória. Tamponamento cardíaco está presente em mais de 80% dos casos, caracterizado por hipotensão, turgência jugular e hipofonese de bulhas cardíacas, podendo haver pulso paradoxal. O local mais comum de ruptura é a parede anterior ou lateral do ventrículo esquerdo.
Diagnóstico
O quadro clínico previamente descrito apresenta importante repercussão hemodinâmica, sendo frequente a identificação de achados compatíveis com tamponamento cardíaco, caracterizados pelas seguintes alterações:
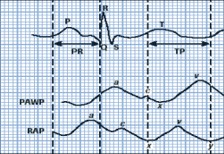
Eletrocardiograma evidencia alterações de importante auxílio à suspeita clínica, como podemos observar na figura (A):
Taquicardia sinusal devido à insuficiência cardíaca diastólica por tamponamento cardíaco.
Alternância elétrica que decorre do movimento pendular do coração no espaço pericárdico, refletindo no ECG por variação da amplitude do QRS em determinadas derivações, de batimento a batimento. É um achado menos frequente, porém patognomônico da doença.
Baixa voltagem (amplitude do complexo QRS inferior a 5 mm ou 0,5 mV nas derivações dos membros e inferior a 10 mm ou 1 mV nas precordiais), diminuição da voltagem decorre do efeito dielétrico (isolante elétrico) do líquido de derrame.
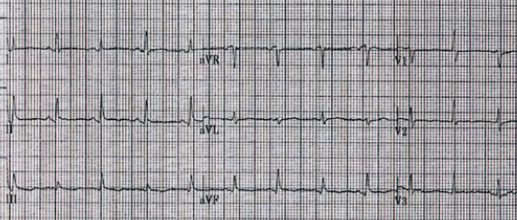
Figura A: taquicardia sinusal, baixa voltagem e alternância elétrica
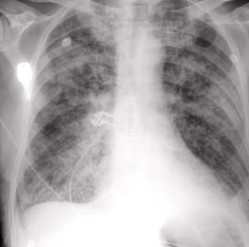
A radiografia de tórax costuma ser normal ou apresentar discreto aumento da área cardíaca, uma vez que, na ruptura de parede livre, o derrame pericárdico geralmente se instala de forma aguda. Alterações mais evidentes na silhueta cardíaca ficam mais evidentes em situações de instalação insidiosa do derrame pericárdico.
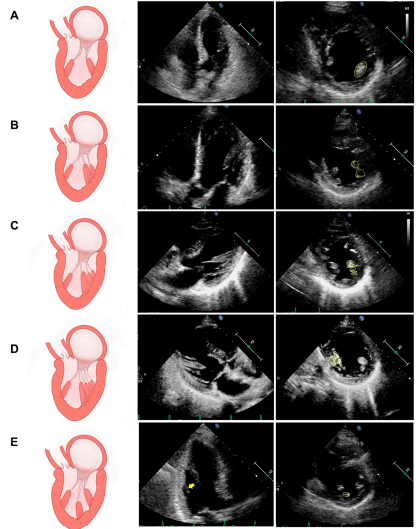
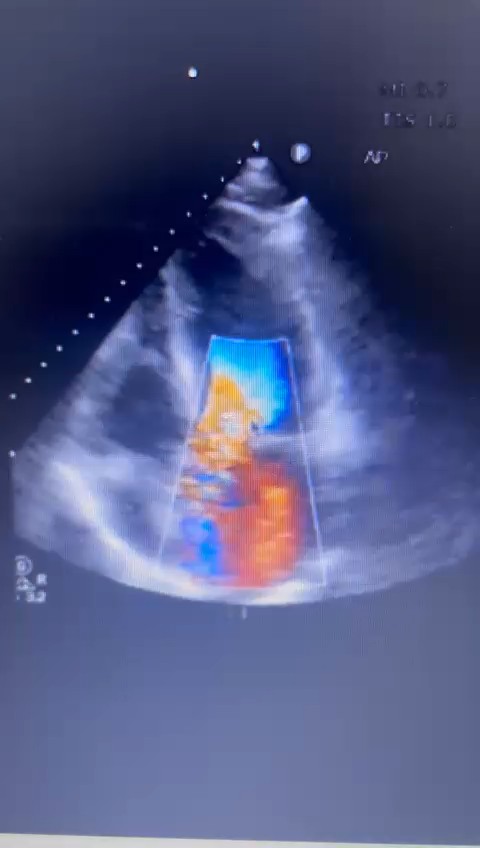
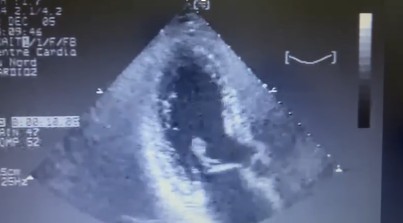
Ecocardiograma é uma importante ferramenta no diagnóstico da ruptura de parede livre bem como do tamponamento cardíaco, fornecendo as informações citadas a seguir, bem como podemos observar em (A) e (B):
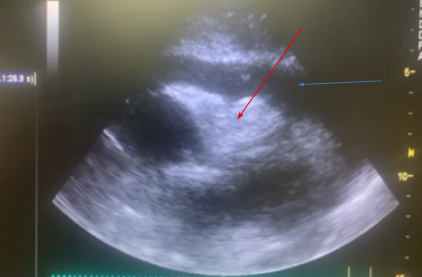
A: derrame pericárdico (seta azul) e colabamento do VD (seta vermelha)
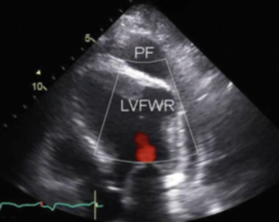
B: derrame pericárdico (PF) e ruptura de parede livre de VE (LVFWR)
No tamponamento cardíaco essas alterações são comumente analisadas:
- Derrame pericárdico
- Colapso diastólico do VD (+ específico)
- Colapso sistólico do AD
- Turgência da VCI sem variação respiratória
- Aumento inspiratório da velocidade da onda E do fluxo de entrada tricúspide > 40%
- Redução inspiratória da velocidade da onda E do fluxo de entrada mitral > 25%
Cateter de artéria pulmonar (Swan-Ganz) com características de choque obstrutivo:
- Índice cardíaco reduzido
- Resistência vascular sistêmica elevada
- Pressão capilar pulmonar elevada
- Pressão venosa central elevada
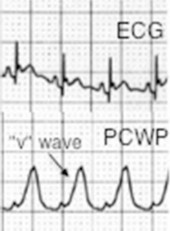
Pode-se observar na PVC, descenso X mais pronunciado e ausência de descenso Y como podemos observar na figura (B).
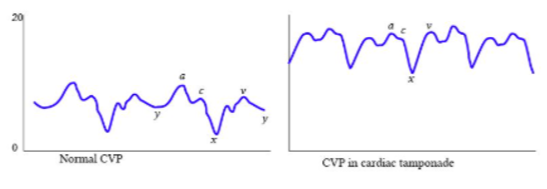
Figura (B): observar descenso X mais profundo e ausência de descenso Y.
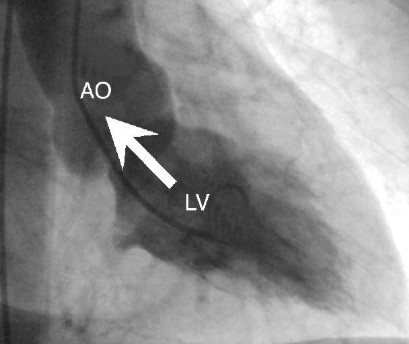
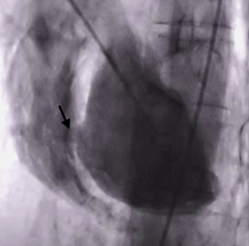
Ventriculografia: ao injetar contraste há a presença de extravasamento de contraste (seta branca):
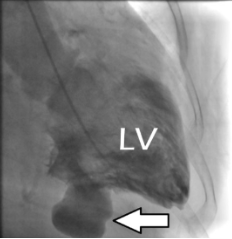
Pseudoaneurisma ventricular / Ruptura contida
Características principais
Entre as principais características, observa-se que cerca de um terço dos casos é diagnosticado nas primeiras duas semanas, tendo tempo médio de diagnóstico em torno de 50 dias. A principal etiologia é o infarto agudo do miocárdio, embora a lesão também possa ocorrer secundariamente a trauma torácico penetrante, endocardite infecciosa ou no pós-operatório de cirurgia cardíaca. Do ponto de vista anatomopatológico, trata-se de uma ruptura miocárdica contida por tecido fibroso, pericárdio e coágulos, o que explica sua apresentação subaguda, como podemos observar na tabela 1.
As localizações mais frequentemente acometidas são a parede inferior ou lateral, apresentando mortalidade inferior a 10%, porém com risco significativo de ruptura, estimado entre 30% e 45%.
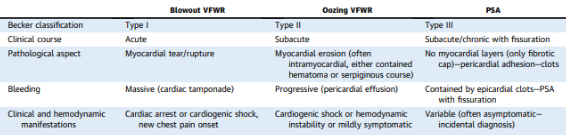
Tabela 1: observamos as características clínicas e patológicas da ruptura de parede livre ventricular e pseudoaneurisma com as classificações (Becker e de Matteucci), exibindo o caráter mais subagudo/crônico do pseudoaneurisma.
PSA: pseudoaneurisma
Apresentação
Pode ser um achado de exame complementar (assintomático), bem como levar a sintomas de insuficiência cardíaca, dor torácica, arritmias ou mesmo fenômenos embólicos.
Exames de imagem
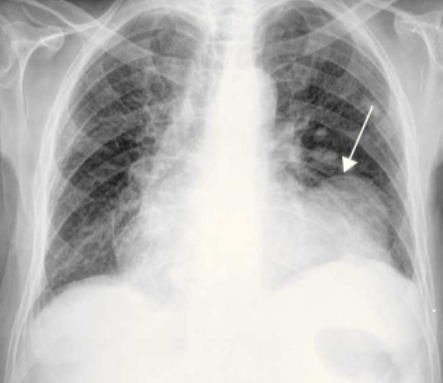
Ragiografia de tórax, evidenciando pseudoaneurisma (seta branca):
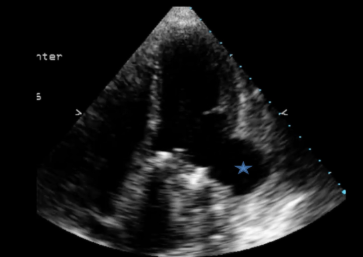
Ecocardiograma, evidenciando pseudoaneurisma (asterisco azul):
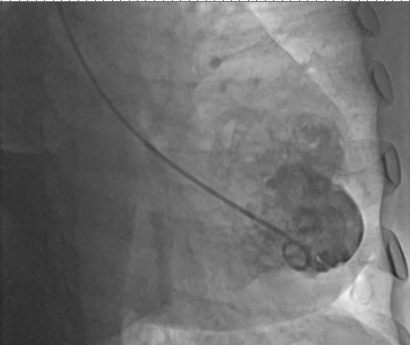
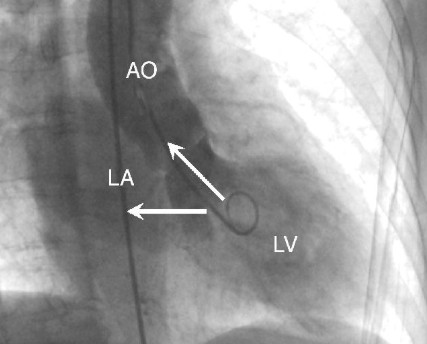
Ventriculografia, evidenciando pseudoaneurisma.
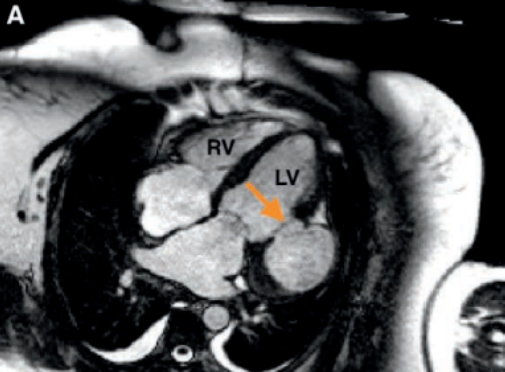
Ressonância magnética, evidenciando pseudoaneurisma (seta laranja)
Diferenças
Pseudoaneurisma VS Aneurisma ventricular
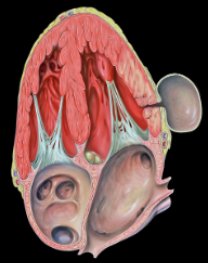

Existem inúmeras diferenças entre essas duas entidades, sendo que no aneurisma ventricular suspeita-se de sua gênese no pós IAM quando há persistência do supradesnivelamento do segmento ST, geralmente localizado nas paredes anterior/apical. No quadro abaixo há um comparativo entre ambos, sendo importante salientar que no aneurisma ventricular a indicação de intervenção cirúrgica (aneurismectomia) fica reservado para situações específicas como arritmia refratária ao tratamento medicamentoso e ablação, tromboembolismo refratário ao tratamento medicamentoso e sintomas de insuficiência cardíaca refratária ao tratamento medicamentoso.
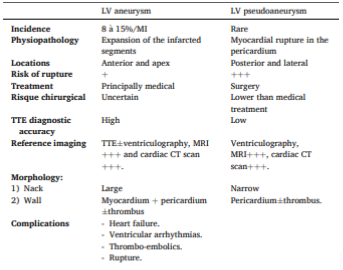
Quadro comparativo entre as principais características do aneurisma ventricular e o pseudoaneurisma.
Manejo clínico até o reparo
Objetivos:
- Fornecer suporte hemodinâmico até a cirurgia.
Terapia de suporte (expansão volêmica, vasopressor, inotrópico, pericardiocentese).
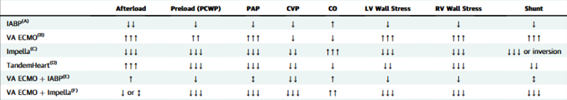
Suporte mecânico (BIA, ECMO).
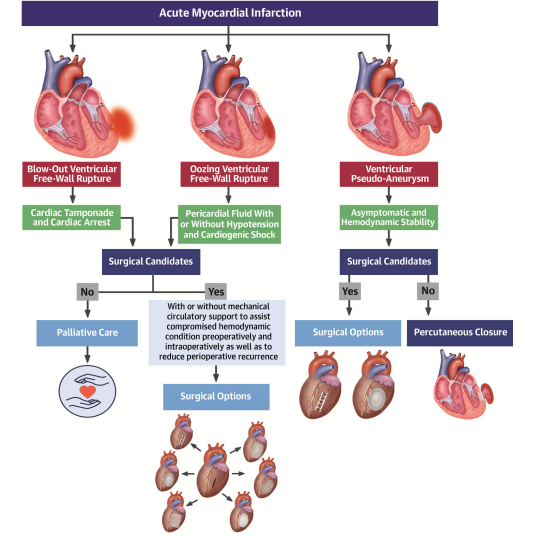
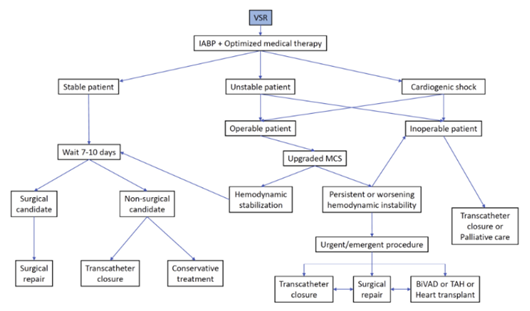
Figura C: condutas de intervenção frente aos diversos tipos de ruptura de parede livre
Referências:
-
- Lorusso R, Cubeddu RJ, Matteucci M, Ronco D, Moreno PR. Ventricular Pseudoaneurysm and Free Wall Rupture After Acute Myocardial Infarction: JACC Focus Seminar 4/5. Vol. 83, Journal of the American College of Cardiology. Elsevier Inc.; 2024. p. 1902–16.
- Damluji AA, Van Diepen S, Katz JN, Menon V, Tamis-Holland JE, Bakitas M, et al. Mechanical Complications of Acute Myocardial Infarction: A Scientific Statement From the American Heart Association. Vol. 144, Circulation. Lippincott Williams and Wilkins; 2021. p. E16–35.
- Gong FF, Vaitenas I, Malaisrie SC, Maganti K. Mechanical Complications of Acute Myocardial Infarction: A Review. JAMA Cardiol. 2021 Mar 1;6(3):341–9.
- Muthiah R. “Swiss-Cheese” Left Ventricle in Acute Myocardial Infarction—A Case Report. Case Reports in Clinical Medicine. 2017;06(02):36–58.
- Parrillo JE., Dellinger RPhillip. Critical care medicine : principles of diagnosis and management in the adult. Elsevier; 2019.
- Friedmann AA. Eletrocardiograma no tamponamento cardíaco. 2019;24(4):161–3.
- El ouazzani J, Jandou I. Aneurysm and pseudoaneurysm of the left ventricle. Vol. 75, Annals of Medicine and Surgery. Elsevier Ltd; 2022.
Assista ao vídeo
No quarto episódio da série Fundamentos em Síndrome Coronária Aguda – tudo o que você precisa saber sobre complicações pós-infarto agudo do miocárdio, o Dr. Cesar Augusto Caporrino explica como identificar e tratar a ruptura de parede livre.

 O Triple I - InCor Innovation in Intervention
O Triple I - InCor Innovation in Intervention O Triple I - InCor Innovation in Intervention
O Triple I - InCor Innovation in Intervention


 O Triple I - InCor Innovation in Intervention
O Triple I - InCor Innovation in Intervention


